Kiini cha atomu


Kiini cha atomu (pia nyukliasi ya atomu; kwa Kiingereza:atomic nucleus) ni eneo dogo la ndani ya atomu lililosongamana lenye kuundwa na protoni na neutroni lililo katikati ya atomi na linalozungukwa na mzingo elektroni.
Eneo hili liligunduliwa mnamo mwaka 1911 na mwanasayansi Ernest Rutherford kwa kutegemea jaribio la folili ya dhahabu lililofanywa mwaka 1909 na mwanasayansi Geiger–Marsden. Baada ya ugunduzi wa neutroni katika mwaka 1932, modeli za kiini zilizokuwa zikijumuisha protoni na neutroni ziliundwa kwa haraka na Dmitri Ivanenko pamoja na Werner Heisenberg.
Atomu ni chembe ndogondogo zinazounda na kutofautisha elementi mbalimbali kama vile oksijeni, chuma au kaboni. Kila kitu, kama ni gimba mango, gesi au kiowevu, kinaundwa na chembechembe ndogo. Kama kina elementi moja tu, kuna atomu za aina moja tu ndani yake. Vitu vingi vinaundwa na muungano wa elementi tofauti kwa mfano maji kwa oksijeni na hidrojeni. Hapo atomu tofauti zinaunganishwa kuwa molekyuli. Hizi molekyuli ni muungano wa elementi za aina tofauti ("kampaundi": kutoka Kiingereza "compounds"). Chembe ndogo ya kila elementi huitwa atomu. Kila elementi ina atomu za aina yake kulingana na asili yake.
Ndani ya kila atomu tena mna chembechembe ndogo zaidi za aina tofauti, ambazo zinatajwa kama nyutroni, protoni na elektroni. Muundo wa atomu ni kiini cha atomu, ambamo sehemu kubwa ya masi yake inapatikana, kikizungukwa na elektroni kadhaa zinazotembea kwa njia zake nje ya kiini.
Atomi inaundwa na kiini kilicho na chaji chanya, pamoja na wingu la elektroni lenye chaji hasi linaloizunguka, vyote vikishikiliwa na nguvu ya umeme-tuli.
Kiini kinaundwa na protoni na nyutroni[1] na hizi kwa pamoja huitwa "nyukleoni" [2].
Kiini chenyewe kina masi karibu yote ya atomu ndani yake (mnamo 99.9%, elektroni kwenye mzingo huwa na masi ndogo mno). Hivyo karibu uzito wote wa atomi unapatikana katika kiini, ukichangiwa na asilimia chache za wingu la elektroni. Protoni na neutroni zinafungamanishwa pamoja kuunda kiini kwa nguvu ya nyuklia.
Kipenyo cha kiini kipo kati ya femtomita 1.75 kwa hidrojeni (sawa na kipenyo cha nyutroni moja)[3] hadi fentomita 15 kwa atomu nzito kama vile urani. atomu yenyewe, yaani kiini pamoja na mizingo elektroni, ni kubwa zaidi mara 23,000 (urani) hadi 145,000 (hidrojeni).
Ugunduzi
[hariri | hariri chanzo]Ugunduzi wa nadharia ya atomu na wa kuwa ndani yake kuna elektroni ulileta maswali mengi ambayo awali hayakupatiwa majibu. Atomu ilijulikana kiumeme kuwa haikuwa na chaji ya aina yoyote, lakini chembe cha elektroni zilizomo ndani ya atomu zilijulikana kuwa na chaji hasi za umeme. Hivyo lazima ndani ya atomu (ambayo haina chaji) kutakuwa na chaji aina nyingine (ambayo ni lazima iwe chaji chanya) ambayo inaletwa uwiano sawa wa kuifanya atomu kwa jumla kutokuwa na chaji. Fumbo gumu zaidi lilikuwa ni kwa namna gani hizo aina mbili za chaji zinaweza kuwa zimejipanga ndani ya atomu.
Muundo wa J. J. Thomson
[hariri | hariri chanzo]Mawazo ya kwanza kabisa kuhusu muundo wa atomu yalitoka kwa J.J. Thomson. Mwanasayansi huyu alipendekeza kuwa atomu ni kama mpira ambao katika kuta zake una chaji chanya zenye ukubwa sawa na zile za hasi ambazo zinaelea ndani ya mpira. Hii ina maana kama utaweza kufikiria kuweza kuingiza mkono katika atomu na kama una bahati unaweza kutoa elektroni ndani ya atomu.
Muundo huu uliweza kuelezea kwa nini atomu hazina chaji, lakini ulishindwa kujibu maswali mengi yaliyotokana na nadharia nyingine nyingi ambazo zilikuwa zimethibitishwa, hasa zile za umeme na usumaku.
Namna kiini (nyukliasi) ilivyogunduliwa
[hariri | hariri chanzo]Muundo wa atomu wa J. J. Thomson haukuwa na nyukliasi. Mwaka 1909 H. Geiger na E. Marsden walichapisha matokeo ya mlolongo wa majaribio waliyofanya katika chuo kikuu cha Manchester chini ya uongozi wa Ernest Rutherford. Rutherford alikuwa na mvuto mkubwa juu ya sayansi ya mionzi ya radioaktiviti ambayo ilianzishwa na Becquerel na Curies.
Mojawapo ya mafumbuzi ya kwanza yalikuwa kwamba elementi zilitoa chembe za alfa (α-particles). Chembe za alfa ziligundulika kuwa na vitu viwili vilivyokuwa na chaji chanya, na vilibainika kuwa ni atomu za Helium zilizopoteza elektroni mbili. Hivyo chembe alfa zilikuwa ni ayoni za Helium, He2+.
Geiger na Marsden walielekeza mkondo wa chembe alpha katika foili nyembamba ya metali. Waligundua kuwa chembe zilibadilishiwa njia kwa ukubwa wa nyuzi mbalimbali kutoka ile njia ya awali. Suala la kubadilishwa njia walikuwa wanalitegemea lakini kilichowashangaza ni kiwango cha badiliko la njia. Baadhi zilibadilishwa hadi kufikia nyuzi 150⁰ (nyuzi 180⁰ ni sawa na kuzuiliwa kabisa kupita).
Kutokana na matokeo iliochenya kuwa ni sehemu ndogo sana ya chembe alfa ndizo zilizobadilishwa njia kwa nyuzi nyingi. Lakini la msingi hapa si uchache wake, bali ni nini kilisababisha hii tabia isiyotarajiwa.
Kuwepo kwa kiini ndani ya atomu kulitambuliwa mwaka 1911 na Ernest Rutherford aliyefanya majaribio ya kufyatulia mnururisho wa alfa dhidi ya bati nyembamba ya dhahabu. Yeye alionyesha kuwa atomu zenye chaji chanya zilizotawanya katika kuta zake kama vile alivyofikiri J. J.Thompson zisingeweza kubadili njia kwa nyuzi ndogo. Mabadiliko makubwa ya uelekeo ya chembe chanya yangeweza kutokea kama kungekuwa na mkusanyiko mdogo ndani ya atomu. Rutherford alionyesha kwa kutumia dhahabu kuwa ndani ya atomu kulikuwa na mkusanyiko wa chaji uliosababisha yote hayo. Alisema ungekuwa ndani ya tufe au mpira wenye nusu kipenyo kisichozidi mita 3.2 × 10-14. Kwa atomu nyingine zilizokuwa nyepesi zaidi ya dhahabu, nusu kipenyo ilipungua hadi kufikia mita 3 × 10-15.
Wakati huo, nusu kipenyo cha atomu kilikuwa kimekadiriwa kwenye mita 2 × 10-10, hivyo haikuchukua muda kuona kuwa chaji chanya ndani ya atomu zitakuwa ndani ya tufe ambalo nusu kipenyo chake ni kama mara 10000 hadi 100000 ya nusu kipenyo cha atomu yote.
Kwa maneno mengine, Rutherford, Geiger na Marsden walikuwa wameanzisha nadharia kuwa atomu zina nyukliasi ndani yake.
Ugunduzi wa nadharia ya atomu na wa kuwa ndani yake kuna elektroni ulileta maswali mengi ambayo hayakupatiwa majibu. Atomu ilijulikana kiumeme kuwa haikuwa na chaji ya aina yoyote, lakini chembe cha elektroni zilizomo ndani ya atomu zilijulikana kuwa na chaji hasi za umeme. Hivyo lazima ndani ya atomu (ambayo haina chaji) kutakuwa na chaji aina nyingine (ambayo ni lazima iwe chaji chanya) ambayo inaletwa uwiano sawa wa kuifanya atomu kutokuwa na chaji. Fumbo gumu zaidi lilikuwa ni kwa namna gani hizo aina mbili za chaji zinaweza kuwa zimejipanga ndani ya atomu.
Ugunduzi wa protoni
[hariri | hariri chanzo]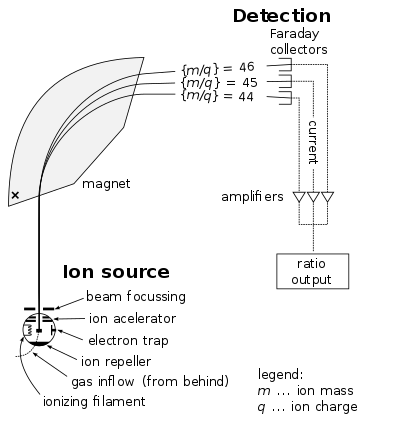
Ilikuwa imejulika kuwa chaji chanya, zinazoifanya atomu kutokuwa na chaji hata kama kuna chaji za elektroni, zilikuwa zinapatikana ndani ya nyukliasi. Hivyo hizi chaji ndani ya nyukliasi ziliaminika kutoka ndani ya chembechembe zilizokuja kufahamika kama protoni. Kwa kuwa atomu haina chaji, basi chaji ya protoni ni sawa kabisa na ile ya elektroni isipokuwa yenyewe ni chanya na ile ya elektroni ni hasi.
Njia iliyotumika katika kuthibitisha uwepo wa protoni ni kifaa kilichoitwa mass spectrograph. Muundaji wa kifaa hiki alikuwa F. W. Aston. Katika kifaa chake, atomu zilizochajiwa chanya zilipitishwa katika eneo la usumaku. Eneo hili liliundwa ili kuleta atomu zenye tungamo tofautitofauti kwenye filamu. Wakati filamu ilipoboreshwa, mistari ingeweza kuonekana kulingana na ayoni zilivyoifikia. Kwa jinsi Aston alivyounda kifaa chake ilimaanisha mistari ingekuwa katika umbo la parabola.
Suala msingi kuhusu kifaa hicho (mass spectrograph) ni kuwa njia inayopitiwa na ayoni inapinda wakati ikisafiri katika eneo la usumaku. Kupinda huku kunategemea vitu wiwili: chaji ya ayoni, q, na tungamo lake, m. Ayoni iliyokuwa na uwiano sawa wa chaji kwa tungamo, q/m zitawasili katika sehemu kwenye filamu. Kwa kufanya jaribio hili kwa uangalifu na hisabati, Aston aliweza kupima uwiano wa chaji kwa tungamo wa idadi kubwa ya ayoni.
Kutokana na matokeo aliunda “kanuni ya namba ya jumla“. Kutokana na kanuni hii uwiano wa chaji na tungamo wa kila ayoni ulikuwa mara kadhaa ya ule wa ayoni za Hydrojeni. Ilionyesha Hydrojeni kuwa ni ayoni iliyojenga ayoni (na atomu) nyingine. Hivyo jina protoni, kutoka neno la Kigiriki ‘protos’ ikimaanisha ‘ya kwanza’, ilipewa ayoni ya hydrojeni.
Namba ya atomu
[hariri | hariri chanzo]Uthibitisho kuwa chaji chanya katika kiini zilikuwa chembe za msingi na muhimu ulitolewa na H. G. J. Moseley. Katika majaribio yake ya mwaka 1913 katika chuo kikuu cha Manchester, Moselay aligongesha elementi kadhaa na mionzi ya cathode (elektroni). Nishati iliyotolewa na mionzi ilisababisha elementi kutoa mionzi X. Moselay alichunguza uhusiano kati ya mizunguko (frequency) ya mionzi X na asili ya elementi iliyokuwa inaitoa. Kwa njia hiyo Moselay aliweza kuonyesha kuwa namba ya atomu, ambayo ilikuwa inafahamika kama idadi ya protoni katika nyukliasi, ilipelekea mpangilio wa elementi katika Jedwali la Elementi (Mfumo radidia).
Ugunduzi wa neutroni
[hariri | hariri chanzo]Miongoni mwa matokeo ya majaribio ya Aston kuna kwamba tungamo la atomu ya oksijeni ilikuwa mara 16 zaidi ya lile la protoni. Kufuatia ugunduzi wa Rutherford wa nyukliasi, na uchunguzi wa Moseley wa namba ya atomu, ilikuwa wazi kuwa nyukliasi ya oksijeni ina chaji chanya nane tu. Hii ilimaanisha ina protoni nane, lakini tungamo la oksijeni lilionyesha kuwa kubwa (karibia mara mbili zaidi) kuliko protoni nane.
Utata huo uliondolewa na James Chadwick mwaka 1932 kwa ugunduzi wa neutroni. Ilichukua muda mrefu tangu majaribio ya Aston (1919) hadi ugunduzi wa neutron (1932). Sababu iliyopelekea kuwa hivi ni kutokuwepo kwa chaji katika neutroni, hivyo kufanya kuwa vigumu kugundulika kwa kutumia usumaku au umeme.
Msingi wa ugunduzi wa Chadwick ulikuwa kama ifuatavyo. Aliweka chanzo cha chembe za alpha kwenye upande mmoja wa foili ya beryllium. Upande mwingine wa beryllium kulikuwa na kinasa chembe (detector) cha alpha ambacho kiligundua uwepo wa ayoni. Katika mpangilio huu, ayoni hazikuweza kugundulika katika kinasa chembe. Kisha mche wa paraffin uliwekwa katikati ya beryllium na kinasa chembe, hali iliyopelekea kinasa chembe kugundua uwepo wake. Hivyo lazima kutakuwa na chembechembe zilizotoka katika beryllium na kusababisha pambano ambalo lilipelekea ayoni kugundulika katika kinasa chembe za ayoni. Hizi chembechembe zilikuja kugundulika kuwa ni neutroni.
Baada ya kugundua uwepo wa nyutroni, Dmitri Ivanenko alitunga maelezo ya kiini cha atomu kuwa nyutroni na protoni.[4][5][6][7][8][9]
Idadi ya protoni katika kiini inafanya namba atomua. Namba ya nyukleoni (protoni na nyutroni kwa pamoja) hufanya namba ya masi. Masi ya atomu thabiti zinazotokea kiasili ziko kati ya 1 (hidrojeni) na 238 (urani). atomu zenye masi kubwa zaidi hazitokei duniani kiasili maana si thabiti.
Ukubwa wa kiini cha atomu ni takriban femtomita 1.6 (10-15 m) (hidrojeni) hadi femtomita 15 (urani).
Ilhali karibu masi yote imo ndani ya kiini, nafasi yake ni ndogo na sehemu kubwa ya nafasi ya atomu huchukuliwa na mzingo elektroni.
Kwa hali ya kawaida atomu haionyeshi chaji ya umeme. Ina chaji ndani yake kulingana na idadi ya protoni ambazo ni chanya na elektroni ambazo ni hasi. Katika hali ya kawaida idadi yake ni sawa, kwa hiyo chaji zinabatilishana. Lakini kama elektroni zinaondoka katika mzingo elektroni hali inabadilika na atomu huonyesha chaji. Kiini cha atomu peke yake daima kina chaji chanya maana hakina elektroni zilizomo katika mzingo.
Ulinganifu wa elektroni, protoni na neutroni
[hariri | hariri chanzo]Tungamo la protoni lilikuwa kwa kiasi fulani rahisi kupima kwa kutumia mass spectrograph. Hata hivyo njia hiyo haiwezi kutumika kupima tungamo la neutroni. Badala yake, neutroni ziligongeshwa na chembe nyingine za atomu. Mwendokasi na tungamo za chembe zilizotolewa (emitted) zilipimwa. Kwa kutumia kanuni ya utunzaji wa momentamu (The Law of Conservation Momentum), iliwezekana kukokotoa tungamo la neutroni. Tungamo la neutroni lilibainika kuwa karibu sawa na lile la protoni. Angalia jedwali hapa chini.
| chembe | tungamo (kg) | chaji | uwiano wa chaji kwa tungamo (C/kg) |
|---|---|---|---|
| elektroni | 0.00091 x 10-27 | hasi (-) | -1.758820150 x 1011 |
| neutroni | 1.6749 x 10-27 | haina chaji | 0 |
| protoni | 1.6726 x 10-27 | chanya (+) | 9.5788339 x 107 |
Hitimisho
[hariri | hariri chanzo]Ni muhimu kufahamu kuwa ingawa atomu imeundwa na chembechembe tofauti, yenyewe kwa jumla haina chaji ya aina yoyote. Hii ni kwa sababu atomu zina idadi sawa ya protoni (chaji chanya) na elektroni (chaji hasi). Idadi ya neutroni (haina chaji) katika nyukliasi ya atomu si lazima iwe sawa na idadi ya protoni au elektroni. Tofauti hiyo ya neutroni katika nyukliasi za atomu ya elementi moja hupeleka kuwa na isotopes za elementi. Elektroni hutembea kuzunguka nyukliasi ya atomu. Ikiwa atomu ina chaji, hii ni kwa sababu imepata (na kuwa na chaji hasi) au imepoteza (na kuwa chaji chanya) elekroni; lakini si kwa sababu idadi yake ya protoni imebadilika.
Angalia pia
[hariri | hariri chanzo]Tanbihi
[hariri | hariri chanzo]- ↑ isipokuwa atomu ya hidrojeni, ambayo ni atomu ndogo kabisa, ina protoni 1 pekee katika kiini
- ↑ kutoka Kilatini nucleus = kiini, yaani chembe za kiini
- ↑
Brumfiel, Geoff (Julai 7, 2010). "The proton shrinks in size". Nature. doi:10.1038/news.2010.337.
{{cite journal}}: CS1 maint: date auto-translated (link) - ↑ Iwanenko, D.D. (1932). "The neutron hypothesis". Nature. 129 (3265): 798. Bibcode:1932Natur.129..798I. doi:10.1038/129798d0.
- ↑ Heisenberg, W. (1932). "Über den Bau der Atomkerne. I". Z. Phys. 77: 1–11. Bibcode:1932ZPhy...77....1H. doi:10.1007/BF01342433.
- ↑ Heisenberg, W. (1932). "Über den Bau der Atomkerne. II". Z. Phys. 78 (3–4): 156–164. Bibcode:1932ZPhy...78..156H. doi:10.1007/BF01337585.
- ↑ Heisenberg, W. (1933). "Über den Bau der Atomkerne. III". Z. Phys. 80 (9–10): 587–596. Bibcode:1933ZPhy...80..587H. doi:10.1007/BF01335696.
- ↑ Miller A. I. Early Quantum Electrodynamics: A Sourcebook, Cambridge University Press, Cambridge, 1995, ISBN 0521568919, pp. 84–88.
- ↑ Fernandez, Bernard; Ripka, Georges (2012). "Nuclear Theory After the Discovery of the Neutron". Unravelling the Mystery of the atomuc Nucleus: A Sixty Year Journey 1896 — 1956. Springer. uk. 263. ISBN 9781461441809.
{{cite book}}: External link in|chapterurl=|chapterurl=ignored (|chapter-url=suggested) (help); Unknown parameter|lastauthoramp=ignored (|name-list-style=suggested) (help)
Marejeo
[hariri | hariri chanzo]Atkins, P. W. (1990). Physical Chemistry, Oxford University Press, Oxford.
Matthews, P. S.C. (1986). Quantum Chemistry of Atoms and Molecules, Cambridge Unversity Press, Cambridge.
Matthews, P. (2003). Advanced Chemistry, Cambridge Unversity Press, Cambridge.
Viungo vya nje
[hariri | hariri chanzo]- Kemia: Atomu na Muundo wa Atomu
- Historia ya Atomu Archived 30 Novemba 2016 at the Wayback Machine.
| Makala hii kuhusu mambo ya kemia bado ni mbegu. Je, unajua kitu kuhusu Kiini cha atomu kama historia yake au mahusiano yake na mada nyingine? Labda unaona habari katika Wikipedia ya Kiingereza au lugha nyingine zinazofaa kutafsiriwa? Basi unaweza kuisaidia Wikipedia kwa kuihariri na kuongeza habari. |
