Asidi amino

Makala hii ina dalili ya kutungwa kwa kutegemea programu ya kompyuta kama vile "Google translation" au "wikimedia special:content translation" bila masahihisho ya kutosha. Watumiaji wanaombwa kuchunguza tena lugha, viungo na muundo wake. Wakiridhika na hali yake wanaweza kuondoa kigezo hiki kinachoonekana kwenye dirisha la kuhariri juu ya matini ya makala kwa kutumia alama za {{tafsiri kompyuta}} .
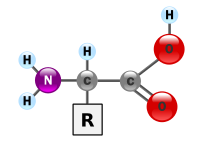

Asidi amino ni molekyuli zilizo na kikundi cha amaini, kikundi cha asidi ya kaboksili na mnyororo wa upande ambao unatofautiana katika asidi amino mbalimbali. Molekyuli hizi zina vipengele muhimu vya kaboni, hidrojeni, oksijeni na nitrojeni. Molekyuli hizi ni muhimu sana hasa katika biokemia, ambapo neno hili kwa kawaida huashiria asidi amino alfa zilizo na fomula ya jumla H2NCHRCOOH, ambapo R ni kibadala cha kiogani.[1] Katika asidi amino alfa, kikundi cha amino kimeunganishwa na atomu ya kaboni kinachopakana na kikundi cha kaboksili (kaboni ya α), lakini kumbuka kwamba aina nyingine za asidi amino huwepo wakati kikundi cha amino kimeunganishwa kwa atomu nyingine ya kaboni (kwa mfano, katika asidi za amino za gama kama vile asidi amino butireti ya gama atomu ya kaboni ambapo kikundi cha amino hujiunga hujitenga kutoka kwa kikundi cha kaboksili na atomu zingine mbili). Amino asisi za alfa zinatofautiana katika upande ambao mnyororo (kikundi R) unapounganishwa na kaboni yao ya alfa na hizi zinaweza kutofautiana kwa ukubwa kutoka kwa atomu moja tu hidrojeni katika glaisini au kikundi cha methili katika alanini, hadi kwa kundi kubwa la heterosaikliki katika triptofani.
Asidi amino ni muhimu kwa uhai, na huwa na majukumu mengi katika umetaboli. Kazi muhimu hasa ni kutumika kama miundo msingi ya ujenzi wa protini, ambayo ni minyororo tu ya asidi amino. Kila protini hufafanuliwa kikemikali kwa mpangilio wa mabaki ya asidi amino, muundo msingi na hii, kwa upande wake, huamua muundo wao wa sekondari (kwa mfano sifa zilizoelezewa vizuri kama vile helisi alfa au karatasi beta za mkunjo), mfumo wa tatu (umbo la protini binafsi, kwa mfano umbo la tufe kama katika kimeng'enya au kama safu katika kolajeni) au muundo wa nne (sura jumla ya changamano ya protini iwapo monoma zimepangwa kwa pamoja, kama katika mchangamo wahimoglobini, ambayo inajumuisha monoma nne ambazo zimeshikiliwa pamoja na vifungo vya hidrojeni ambavyo vina uwezo wa kuja pamoja wakati moja au zaidi yazo inapoifunga molekuli nyingine kwa mfano oksijeni ). Kama vile herufi za alfabeti zinaweza kuwekwa pamoja na kuunda orodha isyo na mwisho ya maneno, asidi amino inaweza kuunganishwa pamoja kwa utaratibu tofauti na kuunda aina nyingi ya protini.[2] Asidi amino ni muhimu pia katika molekuli nyingine nyingi za bayolojia , kwa mfano huwa na majukumu muhimu katika vimeng'enya mwenza kama vile S adenosilmethionini. Kutokana na majukumu yao muhimu katika biokemi, asidi amino ni muhimu sana katika lishe na ni kawaida kutumiwa katika teknolojia ya chakula na viwanda. Kwa mfano, monosodiamu glutamati ni kiimarisha ladha cha kawaida ambacho hupatia vyakula ladha iitwayo umami. Pia hutumika katika sekta ya viwanda ambapo matumizi ni pamoja na uzalishaji wa plastiki bayochungulika, madawa ya kulevya na vichocheo vya chirali.
Historia
[hariri | hariri chanzo]Asidi amino za kwanza ziligunduliwa mapema miaka ya 1800. Katika 1806, na wanakemia wa Kifaransa Louis-Nicolas Vauquelin na Pierre Jean Robiquet waliutenga mchanganyiko katika asparaga ambayo ilipatikana kuwa asparagini, na kuwa asidi amino ya kwanza kugunduliwa.[3][4] Asidi amino nyingine iliyogunduliwa mapema karne ya 19 ilikuwa sistini, katika 1810,[5] ingawa monoma yake, sisteini, ilikuja kugunduliwa miaka mingi baadaye, katika 1884.[4][6] Leucine Glycine na pia ziligunduliwa katika wakati huu, katika 1820.[7] Matumizi ya neno "amino acid" katika lugha ya Kiingereza ni kutoka 1898[8].
Muundo jumla
[hariri | hariri chanzo]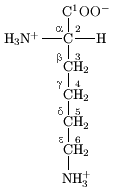
Katika muundo ulioonyeshwa katika sehemu ya juu ya ukurasa, R inawakilisha upande wa mnyororo maalum kwa kila asidi amino. Atomu ya kaboni karibu na kikundi cha kabonili inaitwa α-kaboni na asidi amino na mnyororo upande bonded na dioksidi hii inajulikana kama asidi amino alpha. Hii ndio miundo inayopatikana sana katika maumbile. Katika asidi amino ya alfa, kaboni-α ni atomu ya kaboni chirali , isipokuwa ile ya glaisini.[9] Katika asidi amino ambazo zina mnyororo wa kaboni iliyoshikana na kaboni-α (kama vile laisini, imeonyesha kulia) kaboni zimepewa majina yafuatavyo α, β, γ; δ, na kadhalika.[10] Katika asidi amino fulani, kikundi cha amino kimeshikana na β au γ-kaboni, na hizi kwa hiyo zinajulikana kama asidi amino za beta au gamma .
Asidi amino ni kwa kawaida zimegawanishwa kwa asili mnyororo yao ya upande katika makundi manne. Mnyororo wa upande unaweza kufanya asidi amino iwe asidi dhaifu au besi dhaifu, na iwe hidrofili kama mnyororo wa upande ni ncha au hidrofobi kama si ncha.[9] Mifumo ya kemikali ishirini na mbili za asidi amino za kawaida, pamoja na sifa zao za kemikali, zimeelezewa zaidi katika makala ya asidi amino za proteinojeniki.
Maneno ya "asidi amino yenye matawi" au BCAA yanahusu asidi amino yenye minyororo upande alifatiki usio kwenye laini , hizi ni liusini, isolusini, na valini. Prolini ni asidi amino ya proteinojeniki tu ambayo kundi lake la kando limeungana na kikundi cha amino-α, hivyo, pia ni asidi amino ya proteinojeniki ambayo ina amino ya pili katika nafasi hii.[9] Kemikali, proline basi ni asidi imino kwani inakosa kikundi cha amino ya msingi,[11] ingawa bado inaorodhwashwa kama asidi amino utaratibu wa majina wa sasa, [12] na pia inaweza kuitwa "asidi amino alfa yenye alikali-N".[13]

Waisoma
[hariri | hariri chanzo]Kwa asidi amino-α za kawaida, zote ila glaisini zinaweza kuwepo kwa aidha ya isoma zionekanazo mbili, ziitwazo asidi amino L au D , ambazo ni zinafanana kama shilingi kwa ya pili (tazama pia Chirality). Wakati asidi L-amino zinawakilisha asidi amino zote zinazopatikana kwa protini ya wakati wa tafsiri ya ribosomu, asidi amino D ni protini ambazo hupatikana katika baadhi ya protini zilizotayarishwa na vimeng'enya wakati baada ya kutafsiriwa kimuundo baada ya kutafsiriwa na kuchukuliwa na hadi kwa endoplasmu retikulamu kama katika viumbe wa baharini wa kipekee kama vile konokono koni.[14] Pia ni sehemu nyingi za ukuta wa seli wa peptidoglikani za bakteria.[15] na serini-D huweza kutendakazi kama nyurotransmita katika ubongo.[16] Mpangilio wa L na D kwa muundo wa asidi amino hairejelei jinsi asidi inavyoonekana, bali kwa kuzunguka kwa macho kwa aisoma ya gliseralidehidi ambayo asidi amino ambayo inaweza kinadharia kutengezwa kutoka kwayo(gliseraldehidi-D ni deksitrorotari, L - glyceraldehidi ni levorotari). Vinginevyo, viashiria vya (S) na R) (hutumiwa kuonyesha stereokemia kamili. Takriban asidi amino zote katika protini ni (S) katika kaboni α, huku sistini ikiwa (R) na glisini siyo chirali.[17] Sistini si ya kawaida kwani ina chembe ya sulfuri katika nafasi ya kwanza katika mnyororo wake wa upande, ambayo ina uzani mkubwa wa atomia kuliko makundi yaliyoshikana na kaboni α katika asidi nyingine, hivyo (R) badala ya (S ).
Zwiterioni
[hariri | hariri chanzo]Asidi amino inaamaini naasidi ya kaboksili vikundi vya kazi na kwa hiyo wote ni asidi na besi wakati huo huo.[9] Katika baadhi ya pH inayojulikana kama ncha ya isoelektriki na asidi kwa ujumla haina chaji, kwa vile idadi ya vikundi vya amonia vilivyo na protoni (chaji chanya) na vikundi vya kaboksili zisizo na protoni(bila chaji chanya) ni sawa.[18] Asidi amino zote zina ncha tofauti za ki-isoelektriki. Ayoni zinazozalishwa katika ncha ya isoelektriki huwa na chaji chanya na chaji hasi na hujulikana kama zwitterioni, ambayo huja kutoka neno la Kijerumani Zwitter maana "huntha" au "mchanganyiko".[19] Asidi amino inaweza kupatikana kama zwiterioni katika mango na ufumbuzi kama vile maji, lakini si katika awamu ya gesi.[20] Zwiterioni huwa na umumunyifu mdogo katika ncha yake ya kielektriki na asidi amino na inawezakutengwa kwa kutumia kutuama kutoka kwa maji kwa kubadilisha PH yake hadi kwa ncha yake hasa ya elektriki.
Matukio na kazi katika bayokemia
[hariri | hariri chanzo]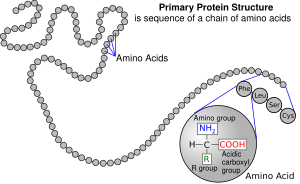
Asidi amino za kawaida
[hariri | hariri chanzo]Asidi amino ni viungo msingi vya kutengeneza protini. Hujiunga pamoja na kuunda minyororo mifupi ya polima ziitwazo peptidi au minyororo mirefu iitwayo aidha polipeptidi au protini. Polima hizi ni zenye matawi na za mistari, na kila asidi amino ndani ya mnyororo imeshikana na asidi amino mbili jirani. Mchakato wa kutengeneza protini huitwa tafsiri na unahusu kuongezwa hatua kwa hatua kwa aidha asidi amino kwa mnyororo unaokuwa wa protini na ribozaimu iitwayo ribosomu.[21] Utaratibu ambao asidi amino zinaongezwa nao unasomwa kutoka kwa programu ya maumbile kutoka kwa programu ya jeni ya mRNA, ambayo ni nakala ya RNA ya jeni ya moja ya kiumbe.
Asidi amino ishirini na mbili kiasili zimejumuishwa katika polipeptidi na huitwa proteinojeniki au asidi amino za kawaida.[9] Kati ya hizi 22 ishirini, ishirini zimejumuishwa moja kwa moja na kanuni kuu ya maumbile. Zilizosalia mbili, selenosistini na pirolisini, hujumuishwa katika protini kwa utaratibu kusanisi wa kipekee. Selenosistini hujumuishwa wakati mRNA inapokuwa ikitafsiriwa ikiwa na kipengele SECIS, ambayo husababisha kodoni ya UGA kuweka Selenosistini badala ya kodoni ya kusimama.[22] Pirolisini hutumiwa na baadhi methanojeni echea katika vimeng'enya vinavyotumika kuzalisha methani. Imewekwa kwa kanuni pamoja na kodoni ya UAG, ambayo kwa kawaida huwa ni kodoni ya kusimama katika viumbe wengine.[23]
Asidi amino zisizo za kawaida
[hariri | hariri chanzo]Mbali na asidi amino za msingi ishirini na mbili, kuna idadi kubwa ya "asidi amino zisizo za kawaida". Hizi asidi amino zisizo za kawaida zinazopatikana kwa protini huundwa kwa mabadiliko baada ya kutafsiriwa, ambayo ni kubadilishwa baada ya tafsiri katika protini ya awali. Mabadiliko haya mara nyingi ni muhimu kwa ajili ya utendajikazi au udhibiti wa protini, kwa mfano, ukabsilishaji wa glutamati unaruhusu kushikilia vizuri kwa kashoni za kalsiamu,[24] na hidroksilesheni ya prolini ni muhimu kwa ajili ya kudumisha tishu zilizoshikana.[25] Mfano mwingine ni uundaji wa hipusini katika kuanzishwa kwa kipengele tafsiri cha EIF5A, kwa kubadilishwa kwa mabaki ya laisini.[26] Mabadiliko kama hayo yanaweza pia kuamua ujanibishaji wa protini, kwa mfano, nyongeza ya makundi marefu ya kukwepamaji kunaweza kusababisha protini kujifunga kwa utando wa fosfolidi.[27]

Mifano ya asidi amino zisizo za kawaida na hazipatikani kwa protini ni pamoja na lanthionini,asidi-aminoisobutiri 2 , dehidroalanini na nyurotransmita asidi ya gama-aminobutiriki. Asidi amino zisizo za kawaida mara nyingi hutokea baina ya njia za metaboli kwa asidi amino za kawaida- kwa mfano orinithini na sitrulini hutokea katika mzunguko wa urea, sehemu ya ukataboli wa asidi amino (angalia hapo chini).[28] Tofauti ya nadra kwa kutawala kwa asidi amino α katika biolojia ni asidi amino β beta alanini (asidi aminopropanu 3), ambayo hutumiwa na mimea na vidubini katika uundaji wa asidi pantotheni (vitamini B 5), sehemu ya kimeng'enya pacha A.[29]
Katika lishe ya binadamu
[hariri | hariri chanzo]Baada ya kupelekwa katika mwili wa binadamu kutoka kwa chakula, aina 22 za asidi amino hutumiwa kutengeza protini na bayomolekuli nyingine au huoksidishwa na kuwa urea na kaboni dioksidi kama chanzo cha nishati.[30] Njia ya uoksidishaji huanza na kuondolewa kwa kikundi cha amino na transaminasi, kundi la amino basi huongezwa katika mzunguko wa urea. Bidhaa nyingine za transamidesheni ni asidi keto ambayo inaingia mzunguko wa asidi sitriki.[31] Asidi amino Glukojeniki pia inaweza kugeuzwa kuwa glukosi, kupitia glukoneojenesi.[32]
Pirolisini bainishi iko kwa vijiumbe maradhi kadhaa, na kiumbe kimoja tu kina Pyl na Sec. Kati ya asidi amino ishirini na mbili, nane huitwa asidi amino muhimu kwa sababu mwili wa binadamu hauwezi kuzitengeza kutoka misombo mingine katika ngazi inayohitajika kwa ajili ya ukuaji wa kawaida, hivyo ni lazima zipatikane kutoka kwa vyakula.[33] Hata hivyo, hali ni ya kuchanganya kwani sistini, taurini, tirosini, histidini na arginini ni asidi amino muhimu kiasi kwa watoto, kwa sababu njia za metaboli za kutengeza asidi amino hizi hazijaumbika kikamilifu.[34][35] Kiasi kinachohitajika pia hutegemea umri na afya ya mtu binafsi, hivyo ni vigumu kutoa taarifa ya jumla kuhusu mahitaji ya malazi ya baadhi ya asidi amino.
| Muhimu | Zisizo Muhimu |
|---|---|
| Isoleusini | Alanini |
| Leusini | Asparajini |
| Lisini | Asidi Aspariti |
| Methionini | Sisteini * |
| fenilalanini | Asidi Glutamiki |
| Threonini | Glutamini * |
| Triptofani | Glisini * |
| Valini | Prolini * |
| Selenosistini * | |
| Serini * | |
| Tirosini * | |
| Arginini * | |
| Histidini * | |
| Ornithini * | |
| Taurini * |
(*) Muhimu katika kesi fulani tu.[36][37]
Kazi zisizo za protini
[hariri | hariri chanzo]Kwa binadamu, asidi amino zisizo protini pia zina majukumu muhimu kama viungo vya kati vya metaboli, kama vile katika biosanisi ya nyeurotransmita ya asidi gama aminobutiriki. Asidi amino nyingi hutumiwa katika usanisi wa molekuli nyingine, kwa mfano:
- Triptofani ni mtangulizi wa nyeurotransmita serotonini.[38]
- Glisini ni mtangulizi wa porifirini kama vile heme.[39]
- Arginini ni mtangulizi wa oksidi nitriki.[40]
- Ornithini na S-adenosilmethionini ni tangulizi kwa poliamini.[41]
- Aspartate, glisini na glutamini ni tangulizi kwa nukleotidi.[42]
- Fenilalanini ni mtangulizi wa Fenipropanoidi mbalimbali ambayo ni muhimu katika metaboli ya mimea.
Hata hivyo, si kazi zote za asidi amino nyingi zisizo za kawaida zinajulikana, kwa mfano taurini ni asidi amino kubwa katika misuli na tishu ya ubongo, lakini ingawa kazi nyingi zimependekezwa, wajibu wake hasa katika mwili bado haujatambuliwa.[43]
Baadhi ya asidi amino zisizo za kawaida hutumika katika mimea kama kinga dhidi ya wanyama walao mimea.[44] Kwa mfano kanavanini ni mfano wa argininiambayo hupatikana katika mimea ya jamii ya kunde,[45] na kwa kiasi kikubwa hasa katika Kanavalia gladiata (maharage upanga ).[46] Hii asidi amino hulinda mimea kutoka waporaji kama vile wadudu na inaweza kusababisha ugonjwa kwa watu kama aina fulani ya kunde ni kuliwa bila ya usindikaji.[47] Asidi amino isiyo protini mimosini hupatikana katika aina nyingine ya kunde, hasa Leucaena leucocephala. Mchanganyiko huu ni mfano wa tairosini na inaweza kuwa sumu kwa wanyama wanaolishwa na mimea hiyo.
Matumizi katika teknolojia
[hariri | hariri chanzo]Asidi amino hutumika kwa njia nyingi tofauti viwandani lakini matumizi yao makuu ni kama viziada vyachakula cha mifugo. Hii ni muhimu kwani sehemu kuu ya vyakula hivi, kama vile soya, aidha ina viwango vya chini au hukosa baadhi ya asidi amino muhimu: lisini, methionini, threonini, na triptofani ni muhimu katika uzalishaji wa vyakula hivi.[48] Sekta ya chakula pia ni mtumizi mkubwa wa asidi amino, hasa asidi glutamiki, ambayo hutumiwa kama kiongeza ladha,[49] na Aspartami (aspartili-fanilalanini-1-methili esta) kama kiongeza tamu bandia cha kalori kidogo.[50] Uzalishaji uliosalia wa asidi amino hutumika katika usanisi wa madawa na vipodozi.[48]
| Minyambuliko ya asidi Amino | Matumizi ya Dawa |
|---|---|
| 5-HTP (5-hidroksitriptofani) | Majaribio ya matibabu ya unyogovu.[51] |
| L-dopa (L-dihidroksifenilalanini) | Matibabu kwa Pakinsoni.[52] |
| Eflornithini | Dawa inayozuia dekaboksilasi ya ornithini na hutumiwa katika matibabu ya ugonjwa[53] wa kulala. |
Maumbile jeni yaliyopanuliwa
[hariri | hariri chanzo]Tangu mwaka wa 2001, asidi amino 40 zisizo za kiasili zimeongezwa kwa protini kwa kujenga kodoni ya kipekee (kubadilisha) na uhamisho unaombatana wa jozi ya RNA: aminoacyl - tRNA-sinthetesi jozi kwa usimbaji wa mwili na kemikali tofauti na tabia ya kibayolojia ili kutumika kama chombo cha kuchunguza mfumo wa protini na kazi au kutengeneza mkusanyiko wa protini zilzoimarishwa.[54][55]
Miundo msingi ya kemikali
[hariri | hariri chanzo]Asidi amino ni muhimu kama viambajengo vya gharama ya chini. Misombo hii inatumika katika bwawa la chirali husaidia kujenga miundo mbinu yenye molekuli zenye chirali.[56]
Asidi amino zimechunguzwa kama kitangulizi cha kichocheo chirali, kwa mfano kwa mrundikano wa atomu zisopacha katika hidrojenesheni, ingawa hakuna matumizi yaliyomo kwa sasa.[57]
Plastiki zinazoweza kuvundishwa
[hariri | hariri chanzo]Asidi amino zinaundwa kama sehemu ya polima nyingi zinazoweza kuvundishwa. Vifaa na maombi kama zisizo na madhara ya ufungaji wa mazingira na madawa katika utoaji wa madawa na ujenzi wa uwekaji wa viungo bandia. Polima hizi ni pamoja na polipeptidi poliamidi, poliesta, polisulfuri na polietheni amabzo zina asidi asidi amino kama sehemu ya minyororo yao kuu au imeshikana kama minyororo ya upande. Mabadiliko haya hugeuza maumbile ya polima hizi pamoja na mrundikano wao wa atomu.[58] Mfano mzuri wa nyenzo hizi ni poliaspartati, polima ambayo inaweza kuyeyuka kwa maji na pia inaweza kuvundishwa na bakteria na inaweza kutumika katika utengezaji wa nepi za kutupwa na kilimo.[59] Kutokana na umumunyifu wake na uwezo wa kushikana na molekuli zaidi ya moja za metali, poliaspartati pia hutumika kama ajenti inayoweza kuvundishwa na ya kuzuia ubambuzi.[60][61] Aidha, asidi amino ya kunukia tirosini inaundwa kama iweze kuwa badala ya kwa fenoli zenye sumu kama vile bisfenoli A katika utengenezaji wa polikaboni.[62]
Miitikio
[hariri | hariri chanzo]Kwa kuwa asidi amino ina kikundi cha msingi cha kaboksili na amino, hizi kemikali zinaweza kuwa na athari zinazohusiana na makundi hayo. Hizi ni pamoja na kuongeza nukleofiliki, kutengeza kiunganishi cha amaidi na kutengezwa kwa imini kwa kikundi cha amaini na uundaji wa esterasi, uundaji wa kiunganishi cha amaidi na udikaboksishaji kwa kikundi cha asidi ya kaboksili.[63] Minyororo mingi ya upande ya asidi amino inaweza pia kuwa na miitikio ya kemikali.[64] Aina ya hizi athari huamuliwa na kwa makundi haya kwenye minyororo ya upande na kwa hivyo ni tofauti kati ya aina mbalimbali za asidi amino.
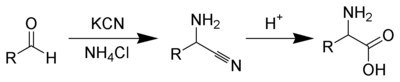
Usanisi wa kemikali
[hariri | hariri chanzo]Mbinu kadhaa zipo za kusanisi asidi amino. Moja ya mbinu kongwe, huanza na kuongezwa kwa bromidikatika kaboni-α ya asidi ya kaboksili. Kubadilisha niuklofili na amonia nayo hubadilisha alkili bromidi kuwa asidi amino.[65] Vinginevyo, usanisi wa asidi amino Strecker unahusisha matibabu ya alidehaidi na potasiamu sianidi na amonia, hii hutoa amino nitrili α kama cha kati. Hidrolisisi ya nitrili katika asidi hutoa asidi amino α.[66] Kutumia amonia au chumvi za amonia katika mmenyuko huu inatoa asidi amino ambazo hazikubadilishana, wakati kubadilisha amini za msingi na upili kutatoa asidi amino zilizobadilishwa.[67] Kadhalika, kutumia ketoni, badala ya aldehidi, inatoa α, asidi amino α zilizobadilishwa.[68] Usanisi wa awali unatoa mchanganyiko rasimu wa asidi amino α kama mavuno, lakini taratibu kadhaa mbadala kwa kutumia mbinu saidizi zisopacha [69] au vichocheo visopacha [70][71]vimeundwa.[72]
Kwa sasa njia inayotumika sana ni usanisi kwa kutumia mashine iliyo na nguzo imara (km shanga za polistirini), kwa kutumia makundi ya kulinda la (kwa mfano, t-Boc) na Fmoc na vikundi viamilishaji (mfano DCC na DIC).
Kuundwa kwa kiunganishi cha Peptidi
[hariri | hariri chanzo]
Kwa kuwa vikundi vyote viwili vya asidi ya kaboksili na amaini vya asidi amino vinaweza kuathiriwa na kuunda viunganishi vya amaidi, molekuli moja ya asidi amino inaweza kuathiriwa na nyingine na kujiunga nayo na kuunda muungano wa amaidi. Huu upolimishaji wa asidi amino ni ndio unaounda protini. Huu mtonesho wa kutonesha unazaa kiunganishi cha peptidi na molekuli ya maji. Katika seli, mwitikio huu hautokei moja kwa moja, badala yake asidi amino kwanza huchochewa kwa kufungiliwa kwa molekuli hamishi yaRNA kupitia kwa kiunganishi cha esta. Hii aminoasili tRNA huzalishwa katika mwitikio unaotegemea ATP unaofanywa na asidi amino tRNA sanisifu.[73] Aminoasili-tRNA hii huwa tena ni sabstreti ya ribosomu, ambayo huchochea ya mashambulizi ya kundi la amino la kurefusha mnyororo wa protini kwa kiunganishi cha esta.[74] Kutokana na utaratibu huu, protini zote zinazotengezwa na ribosomu husanisiwa kuanzia kituo chao cha N na kusonga kuelekea kituo chao cha C.
Hata hivyo, si viunganishi vyote hutengenezwa kwa njia hii. Katika kesi chache, peptidi husanisiwa na vimeng'enya maalum. Kwa mfano, glutathioni tripeptidi ni sehemu muhimu ya ulinzi wa seli dhidi ya dhiki ya uoksidishaji. Peptidi huundwa kutoka katika asidi amino huru kwa hatua mbili.[75] Katika hatua ya kwanza gamma-glutamilisistini sinthetesi hutonesha sistini na asidi ya glutamiki kupitia kwa kiunganishi cha peptidi kilichoundwa kati ya mnyororo wa upande wa kaboksili wa glutameti(kaboni ya gama ya mnyororo huu) na kundi la amino la sistini. Dipeptidi hii basi hutoneshwa na glisini na sinthetesi glutathioni kuunda glutathioni.[76]
Katika kemia, peptidi husanisiwa kupitia m mbalimbali. Moja kati ya sanisi za peptidi za awamu-mango zinazotumika sana, ambayo inatumia vitu vinavyotokana na oksime ya kunukia ya asidi amino kama vipande vilivyooamilishwa. Hizi huongezwa kwa mlolongo unaokua kwenye mnyororo wa peptidi, ambayo imeshikanishwa na utomvu imara.[77] Uwezo wa kusanisi idadi kubwa ya peptidi tofauti kwa kubadilisha aina tofauti na utaratibu wa asidi amino (kutumia kemia ya kuunganisha) imefanya usanisi wa peptidi kuwa muhimu katika kujenga maktaba ya peptidi kwa matumizi ya ugunduzi wa madawa kwa njia ya uchunguzi hali ya juu.[78]
Biosanisi na ukataboli
[hariri | hariri chanzo]Katika mimea, nitrojeni kwanza hulishizwa kwenda kwa misombo ya kikaboni katika mfumo wa glutemeti, hutengenezwa kutoka kwa alfa-ketoglutareti na amonia katika mitokondria. Ili kuunda asidi amino nyingine, mmea hutumia transaminasi kusongesha kikundi cha amino kwenda kwa asidi alfa-keto kaboksili nyingine. Kwa mfano, aminotransferasi aspartati hubadilisha glutameti na oksaloasetati kuwa alfa-ketoglutareti na asparteti.[79] Viumbe wengine hutumia transaminasi kwa usanisi wa asidi amino pia. Transaminasi pia hushiriki katika kuvunja asidi amino. Udhalilishaji wa asidi amino mara nyingi unahusisha kusongesha kundi lake la amino kwenda kwa alfa-ketoglutareti na kutengeneza glutameti. Katika wanyama wenye uti wa mgongo wengi, kikundi cha amino kisha huondolewa kwa njia ya mzunguko wa urea na kisha kuondolewa mwlilini kwa fomu ya urea. Hata hivyo, uharibifu wa asidi amino unaweza kutoa asidi mkojo au amonia badala yake. Kwa mfano, kiondoa-oksijeni serini hubadilisha serini kuwa piruvati na amonia.[80]
Asidi amino zisizo za kawaida hutengenezwa kwa kubadilishwa kwa asidi amino za kawaida. Kwa mfano, homosisteini hutengezwa kwa kusongeshwa njia ya sulfuri kwa njia ya kutolewa kwa methili kutoka kwa methionini kupitia kwa kimetaboli kati S-adenosili methionini,[43] wakati hidroksiprolini hutengezwa na kubadilishwa kwa proline baada ya kutafsiriwa ya [81]
Vidubini na mimea inaweza kusanisi asidi amino nyingi zisizo za kawaida. Kwa mfano, baadhi ya vijiumbe maradhi hutengeza asidi amino sobutiriki-2 na lanthionini, ambayo imetokana na sulfidi ya alanini. Asidi amino hizi zote mbili zinapatikana katika lantibiotiki peptidi kama vile alamethisini.[82] Ilihali katika mimea, asidi amino saiklopropani-1-kaboksili ni asidi ndogo iliyobadilishwa ya asidi amino ya mzunguko, ambayo ni muhimu katika uzalishaji homoni kati ya mmea ya ethilini.[83]
Sifa za kemikali za asidi amino
[hariri | hariri chanzo]Asidi amino 20 zinazopatikana kiasili zinaweza kugawanywa katika makundi mbalimbali kulingana na sifa zao. Sababu muhimu ni chaji, kiwango cha kupenda maji au kukwepa maji, ukubwa na vikundi vya kazi [9] . Hizi sifa ni muhimu kwa mfumo wa protini mwingiliano wa protini na protini. Protini mumunyifu kwa maji zinaelekea kuwa na mabaki yao ya kukwepamaji (Leu, Ile, Val, Phe na Trp) kuzikwa katikati ya protini, ilhali minyororo ya kupendamaji hufunuliwa kwa kiyeyusho cha majimaji. Utando wa muhimu wa protini mara nyingi huwa na pete za asidi amino za kukwepamaji iliyoonyeshwa wazi ambazo huzitia nanga katika rusu mbili ya lipidi ya. Katika sehemu ya kesi kati ya njia mbili tofauti sana, baadhi ya tando za protini za pembeni huwa na kiraka cha asidi amino za kukwepamaji juu ya uso wao ambacho hushikilia kwa utando. Vile vile, protini ambazo hufaa kushikilia kwa molekuli zenye chaji chanya huwa na asidi amino zenye chaji hasi kwenye nyuso zao kama vile glutameti na aspartati, wakati protini zinazofaa kushikilia kwa molekuli zenye chaji hasi huwa na nyuso zenye minyororo chaji chanya kama vile lisini na ajinini. Kuna mizani tofauti ya kukwepamaji ya mabaki ya asidi amino.[84]
Baadhi ya asidi amino huwa na sifa za kipekee kama vile seistini, ambayo huweza kutengeneza kiunganishi chenye kugawanyika cha sulfudi na mabaki mengine ya seistini, prolini ambayo inaunda mzunguko kwa uti wa mgongo wa polipeptidi, na glisini ambayo ni rahisi kubadilika zaidi kuliko asidi amino nyingine.
Protini nyingi hupitia mabadliko mengi ya muundo baada ya kutafsiriwa, wakati makundi ya ziada ya kemikali yanaposhikanishwa na asidi amino katika protini. Baadhi ya mabadiliko yanaweza kuzalisha lipoprotini za kukwepamaji,[85] au glikoprotini za kupendamaji.[86] Mabadiliko ya aina hii yaruhusu kulenga kunakoweza kurejeshwa kwa protini kwa utando. Kwa mfano, kuongezwa na kuondolewa kwa asidi yenye mafuta ya asidi ya kiganja kwa mabaki ya seistini katika protini fulani za kuashiria husababisha protini kujiambatanisha na kisha kujitenga kutoka katika utando wa seli.[87]
Orodha ya vifupisho na sifa za asidi amino za kawaida
[hariri | hariri chanzo]| Asidi amino | 3-Herufi[88] | Herufi-1[88] | Mnyororo wa upande:Upola [88] | Chaji ya Mnyororo wa upande (pH 7.4)[88] | Kielelezo cha Hidropatiki[89] | Λ Uwezo wa Kufyonza juu(nm)[90] | ε katikaλ juu (X10 -3 M-1cm-1)[90] | |||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Alanini | Ala | A. | iso pola | sio na sifa zinazobainika | 1.8 | |||||||||||||||||||||||||||||||||||||||||||||
| Arginini | Arg | R | pola | chanya | -4.5 | |||||||||||||||||||||||||||||||||||||||||||||
| Asparagini | Asn | N | pola | sio na sifa zinazobainika | -3.5 | |||||||||||||||||||||||||||||||||||||||||||||
| Asidi Aspartiki | ASP | D | pola | hasi | -3.5 | |||||||||||||||||||||||||||||||||||||||||||||
| Sisteini | Cys | C | iso pola | sio na sifa zinazobainika | 2.5 | 250 | 0.3 | |||||||||||||||||||||||||||||||||||||||||||
| Asidi ya glutamiki | Glu | E | pola | hasi | -3.5 | |||||||||||||||||||||||||||||||||||||||||||||
| Glutamini | Gln | Q | pola | sio na sifa zinazobainika | -3.5 | |||||||||||||||||||||||||||||||||||||||||||||
| Glisini | Gly | G | iso pola | sio na sifa zinazobainika | -0.4 | |||||||||||||||||||||||||||||||||||||||||||||
| Histidini | His | H | pola | chanya (10%) zisizobainika (90%) | -3.2 | 211 | 5.9 | |||||||||||||||||||||||||||||||||||||||||||
| Isoleusini | Ile | I | iso pola | sio na sifa zinazobainika | 4.5 | |||||||||||||||||||||||||||||||||||||||||||||
| Leusini | Leu | L | iso pola | sio na sifa zinazobainika | 3.8 | |||||||||||||||||||||||||||||||||||||||||||||
| Lisini | Lys | K | pola | chanya | -3.9 | |||||||||||||||||||||||||||||||||||||||||||||
| Methionini | Met | M | iso pola | sio na sifa zinazobainika | 1.9 | |||||||||||||||||||||||||||||||||||||||||||||
| Fenilalanini | Phe | F | Iso pola | sio na sifa zinazobainika | 2.8 | 257, 206, 188 | 0.2, 9.3, 60.0 |
- align="center" |
Prolini
Pro |
P | iso pola
sio na sifa zinazobainika |
-1.6 |
- align="center" |
Serini
Ser |
S
pola sio na sifa zinazobainika |
-0.8 |
- align="center" |
Threonini | Thr | T
pola sio na sifa zinazobainika |
-0.7 |
- align="center" |
Triptofani | Trp
W |
iso pola
sio na sifa zinazobainika |
-0.9 | 280, 219 | 5.6, 47.0 |
- align="center" |
Tirosini | Tyr | Y
pola sio na sifa zinazobainika |
−1.3 | 274, 222, 193 | 1.4, 8.0, 48.0 |
- align="center" |
Valini | Val | V | iso pola
sio na sifa zinazobainika |
4.2 | ) |
Zaidi ya hayo, kuna asidi amino mbili za ziada ambazo zinajumuishwa kwa kutotilia manaani kodoni za kuacha:
| asidi amino ya 21 na 22 | Herufi-3 | Herufi-1 |
|---|---|---|
| Selenosisteini | Sec | U |
| Pirolisini | Pyl | O |
Mbali na mfumo maalum za asidi amino, vishikilia sehemu hutumika katika kesi ambapo uchambuzi wa kemikali au wa chembechembe za peptidi au wa protini hauwezi kuamua kikamilifu utambulisho wa mabaki.
| Asidi amino zenye utata | Herufi-3 | Herufi-1 |
|---|---|---|
| Asparagini au asidi aspartiki | Asx | B |
| Glutamini au asidi glutamiki | Glx | Z |
| Leusini au Isoleusini | Xle | J |
| Isoelezewa au asidi amino isojulikana | Xaa | X |
Unk wakati mwingine hutumiwa badala ya Xaa, lakini si kawaida.
Zaidi ya hayo, nyingi zisizo za kawa asidi amino kuwa na mfumo maalum. Kwa mfano, dawa kadhaa za peptidi, kama vile Bortezomibi au MG132 ni zimesanisiwa kibandia na uhifadhi vikundi vyao vya kulinda, ambavyo vina mfumo maalum. Bortezomibi ni Pyz-Phe-boroLeu na MG132 ni Z-Leu-Leu-Leu-al. Zaidi ya hayo, ili kusaidia katika uchambuzi wa mfumo wa protini, mifano ya kuunganisha kwa asidi amino inapatikana. Hizi ni pamoja na fotoleusini (pLeu) na fotomethionini (pMet). [91]
Tanbihi
[hariri | hariri chanzo]- ↑ Prolini inakinzana na fomula hii ya ujumla. Inakosa kundi la NH 2 kwa sababu ya mzunguko wa mnyororo wa upande na kujulikana kama imino asidi; huwa chini ya kikundi cha muundo wa asidi amino maalum.
- ↑ "The Structures of Life". National Institute of General Medical Sciences. Ilihifadhiwa kwenye nyaraka kutoka chanzo mnamo 2014-06-07. Iliwekwa mnamo 2008-05-20.
- ↑ Vauquelin LN, Robiquet PJ (1806). "The discovery of a new plant principle in Asparagus sativus". Annales de Chimie. 57: 88–93.
- ↑ 4.0 4.1 Anfinsen CB, Edsall JT, Richards FM (1972). Advances in Protein Chemistry. New York: Academic Press. ku. 99, 103. ISBN 978-0-12-034226-6.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Wollaston WH (1810). "On cystic oxide, a new species of urinary calculus". Philosophical Transactions of the Royal Society of London. 100: 223–30. doi:10.1098/rstl.1810.0015.
- ↑ Baumann E (1884). "Über cystin und cystein". Z Physiol Chemie. 8: 299.
- ↑ Braconnot HM (1820). "Sur la conversion des matières animales en nouvelles substances par le moyen de l'acide sulfurique". Ann Chim Phys Ser 2. 13: 113–25.
- ↑ "etymonline.com entry for amino". www.etymonline.com. Ilihifadhiwa kwenye nyaraka kutoka chanzo mnamo 2012-10-20. Iliwekwa mnamo 2010-07-19.
- ↑ 9.0 9.1 9.2 9.3 9.4 9.5 Creighton, Thomas H. (1993). "Chapter 1". Proteins: structures and molecular properties. San Francisco: W. H. Freeman. ISBN 978-0-7167-7030-5.
- ↑ "Nomenclature and Symbolism for Amino Acids and Peptides". IUPAC-IUB Joint Commission on Biochemical Nomenclature. 1983. Iliwekwa mnamo 2008-11-17.
- ↑ Jodidi, S. L. (1926-03-01). "The Formol Titration of Certain Amino Acids". Journal of the American Chemical Society. 48 (3): 751–753. doi:10.1021/ja01414a033.
{{cite journal}}:|access-date=requires|url=(help) - ↑ Liebecq, Claude, mhr. (1992). Biochemical Nomenclature and Related Documents (tol. la 2nd). Portland Press. ku. 39–69. ISBN 978-1-85578-005-7.
- ↑ Smith, Anthony D. (1997). Oxford dictionary of biochemistry and molecular biology. Oxford: Oxford University Press. ku. 535. ISBN 978-0-19-854768-6. OCLC 37616711.
- ↑ Pisarewicz K, Mora D, Pflueger FC, Fields GB, Marí F (2005). "Polypeptide chains containing D-gamma-hydroxyvaline". Journal of the American Chemical Society. 127 (17): 6207–15. doi:10.1021/ja050088m. PMID 15853325.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ↑ van Heijenoort J (2001). "Formation of the glycan chains in the synthesis of bacterial peptidoglycan". Glycobiology. 11 (3): 25R–36R. doi:10.1093/glycob/11.3.25R. PMID 11320055.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Wolosker H, Dumin E, Balan L, Foltyn VN (2008). "D-amino acids in the brain: D-serine in neurotransmission and neurodegeneration". The FEBS Journal. 275 (14): 3514–26. doi:10.1111/j.1742-4658.2008.06515.x. PMID 18564180.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ↑ Hatem, Salama Mohamed Ali (2006). "Gas chromatographic determination of Amino Acid Enantiomers in tobacco and bottled wines". University of Giessen. Iliwekwa mnamo 2008-11-17.
- ↑ Fennema OR (1996). Food Chemistry (tol. la 3rd). CRC Press. ku. 327–8. ISBN 0-8247-9691-8.
- ↑ Simmons, William J.; Gerhard Meisenberg (2006). Principles of medical biochemistry. Mosby Elsevier. uk. 19. ISBN 0-323-02942-6.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Remko M, Rode BM (2006). "Effect of metal ions (Li+, Na+, K+, Mg2+, Ca2+, Ni2+, Cu2+, and Zn2+) and water coordination on the structure of glycine and zwitterionic glycine". The journal of physical chemistry. A. 110 (5): 1960–7. doi:10.1021/jp054119b. PMID 16451030.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Rodnina MV, Beringer M, Wintermeyer W (2007). "How ribosomes make peptide bonds". Trends in Biochemical Sciences. 32 (1): 20–6. doi:10.1016/j.tibs.2006.11.007. PMID 17157507.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ↑ Driscoll DM, Copeland PR (2003). "Mechanism and regulation of selenoprotein synthesis". Annual Review of Nutrition. 23: 17–40. doi:10.1146/annurev.nutr.23.011702.073318. PMID 12524431.
- ↑ Krzycki JA (2005). "The direct genetic encoding of pyrrolysine". Current Opinion in Microbiology. 8 (6): 706–12. doi:10.1016/j.mib.2005.10.009. PMID 16256420.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Vermeer C (1990). "Gamma-carboxyglutamate-containing proteins and the vitamin K-dependent carboxylase". The Biochemical Journal. 266 (3): 625–36. PMC 1131186. PMID 2183788.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Bhattacharjee A, Bansal M (2005). "Collagen structure: the Madras triple helix and the current scenario". IUBMB Life. 57 (3): 161–72. doi:10.1080/15216540500090710. PMID 16036578.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Park MH (2006). "The post-translational synthesis of a polyamine-derived amino acid, hypusine, in the eukaryotic translation initiation factor 5A (eIF5A)". Journal of Biochemistry. 139 (2): 161–9. doi:10.1093/jb/mvj034. PMC 2494880. PMID 16452303.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Blenis J, Resh MD (1993). "Subcellular localization specified by protein acylation and phosphorylation". Current Opinion in Cell Biology. 5 (6): 984–9. doi:10.1016/0955-0674(93)90081-Z. PMID 8129952.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Curis E, Nicolis I, Moinard C; na wenz. (2005). "Almost all about citrulline in mammals". Amino Acids. 29 (3): 177–205. doi:10.1007/s00726-005-0235-4. PMID 16082501.
{{cite journal}}: Explicit use of et al. in:|author=(help); Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ↑ Coxon KM, Chakauya E, Ottenhof HH; na wenz. (2005). "Pantothenate biosynthesis in higher plants". Biochemical Society Transactions. 33 (Pt 4): 743–6. doi:10.1042/BST0330743. PMID 16042590.
{{cite journal}}: Explicit use of et al. in:|author=(help); Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ↑ Sakami W, Harrington H (1963). "Amino acid metabolism". Annual Review of Biochemistry. 32: 355–98. doi:10.1146/annurev.bi.32.070163.002035. PMID 14144484.
- ↑ Brosnan JT (2000). "Glutamate, at the interface between amino acid and carbohydrate metabolism". The Journal of Nutrition. 130 (4S Suppl): 988S–90S. PMID 10736367.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Young VR, Ajami AM (2001). "Glutamine: the emperor or his clothes?". The Journal of Nutrition. 131 (9 Suppl): 2449S–59S, discussion 2486S–7S. PMID 11533293.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Young VR (1994). "Adult amino acid requirements: the case for a major revision in current recommendations". The Journal of Nutrition. 124 (8 Suppl): 1517S–1523S. PMID 8064412.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Imura K, Okada A (1998). "Amino acid metabolism in pediatric patients". Nutrition. 14 (1): 143–8. doi:10.1016/S0899-9007(97)00230-X. PMID 9437700.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Lourenço R, Camilo ME (2002). "Taurine: a conditionally essential amino acid in humans? An overview in health and disease". Nutrición Hospitalaria. 17 (6): 262–70. PMID 12514918.
- ↑ Fürst P, Stehle P (2004). "What are the essential elements needed for the determination of amino acid requirements in humans?". The Journal of Nutrition. 134 (6 Suppl): 1558S–1565S. PMID 15173430.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Reeds PJ (2000). "Dispensable and indispensable amino acids for humans". The Journal of Nutrition. 130 (7): 1835S–40S. PMID 10867060.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Savelieva KV, Zhao S, Pogorelov VM; na wenz. (2008). "Genetic disruption of both tryptophan hydroxylase genes dramatically reduces serotonin and affects behavior in models sensitive to antidepressants". PloS ONE. 3 (10): e3301. doi:10.1371/journal.pone.0003301. PMC 2565062. PMID 18923670.
{{cite journal}}: Explicit use of et al. in:|author=(help)CS1 maint: multiple names: authors list (link) CS1 maint: unflagged free DOI (link) - ↑ Shemin D, Rittenberg D (1 Desemba 1946). "The biological utilization of glycine for the synthesis of the protoporphyrin of hemoglobin". Journal of Biological Chemistry. 166 (2): 621. PMID 20276176.
{{cite journal}}: More than one of|pages=na|page=specified (help) - ↑ Tejero J, Biswas A, Wang ZQ; na wenz. (2008). "Stabilization and characterization of a heme-oxy reaction intermediate in inducible nitric-oxide synthase". The Journal of Biological Chemistry. 283 (48): 33498–507. doi:10.1074/jbc.M806122200. PMC 2586280. PMID 18815130.
{{cite journal}}: Explicit use of et al. in:|author=(help); Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) CS1 maint: unflagged free DOI (link) - ↑ Rodríguez-Caso C, Montañez R, Cascante M, Sánchez-Jiménez F, Medina MA (2006). "Mathematical modeling of polyamine metabolism in mammals". The Journal of Biological Chemistry. 281 (31): 21799–812. doi:10.1074/jbc.M602756200. PMID 16709566.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) CS1 maint: unflagged free DOI (link) - ↑ Stryer, Lubert; Berg, Jeremy Mark; Tymoczko, John L. (2002). Biochemistry. San Francisco: W.H. Freeman. ku. 693–8. ISBN 0-7167-4684-0.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ 43.0 43.1 Brosnan JT, Brosnan ME (2006). "The sulfur-containing amino acids: an overview". The Journal of Nutrition. 136 (6 Suppl): 1636S–1640S. PMID 16702333.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Hylin, John W. (1969). "Toxic peptides and amino acids in foods and feeds". Journal of Agricultural and Food Chemistry. 17 (3): 492–6. doi:10.1021/jf60163a003.
- ↑ Turner, B. L.; Harborne, J. B. (1967). "Distribution of canavanine in the plant kingdom". Phytochemistry. 6: 863–66. doi:10.1016/S0031-9422(00)86033-1.
- ↑ Ekanayake S, Skog K, Asp NG (2007). "Canavanine content in sword beans (Canavalia gladiata): analysis and effect of processing". Food and Chemical Toxicology. 45 (5): 797–803. doi:10.1016/j.fct.2006.10.030. PMID 17187914.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ↑ Rosenthal GA (2001). "L-Canavanine: a higher plant insecticidal allelochemical". Amino Acids. 21 (3): 319–30. doi:10.1007/s007260170017. PMID 11764412.
- ↑ 48.0 48.1 Leuchtenberger W, Huthmacher K, Drauz K (2005). "Biotechnological production of amino acids and derivatives: current status and prospects". Applied Microbiology and Biotechnology. 69 (1): 1–8. doi:10.1007/s00253-005-0155-y. PMID 16195792.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ↑ Garattini S (2000). "Glutamic acid, twenty years later". The Journal of Nutrition. 130 (4S Suppl): 901S–9S. PMID 10736350.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Stegink LD (1987). "The aspartame story: a model for the clinical testing of a food additive". The American Journal of Clinical Nutrition. 46 (1 Suppl): 204–15. PMID 3300262.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Turner EH, Loftis JM, Blackwell AD (2006). "Serotonin a la carte: supplementation with the serotonin precursor 5-hydroxytryptophan". Pharmacology & Therapeutics. 109 (3): 325–38. doi:10.1016/j.pharmthera.2005.06.004. PMID 16023217.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ↑ Kostrzewa RM, Nowak P, Kostrzewa JP, Kostrzewa RA, Brus R (2005). "Peculiarities of L: -DOPA treatment of Parkinson's disease". Amino Acids. 28 (2): 157–64. doi:10.1007/s00726-005-0162-4. PMID 15750845.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ↑ Heby O, Persson L, Rentala M (2007). "Targeting the polyamine biosynthetic enzymes: a promising approach to therapy of African sleeping sickness, Chagas' disease, and leishmaniasis". Amino Acids. 33 (2): 359–66. doi:10.1007/s00726-007-0537-9. PMID 17610127.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ↑ Xie J, Schultz PG (2005). "Adding amino acids to the genetic repertoire". Curr Opin Chem Biol. 9 (6): 548–54. doi:10.1016/j.cbpa.2005.10.011. PMID 16260173.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Wang Q, Parrish AR, Wang L (2009). "Expanding the genetic code for biological studies". Chem. Biol. 16 (3): 323–36. doi:10.1016/j.chembiol.2009.03.001. PMC 2696486. PMID 19318213.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ↑ Hanessian, S. (1993). "Reflections on the total synthesis of natural products: Art, craft, logic, and the chiron approach". Pure and Applied Chemistry. 65: 1189–204. doi:10.1351/pac199365061189.
- ↑ Blaser, Hans Ulrich (1992). "The chiral pool as a source of enantioselective catalysts and auxiliaries". Chemical Reviews. 92 (5): 935–52. doi:10.1021/cr00013a009.
- ↑ Sanda, Fumio; Endo, Takeshi (1999). "Feature Article Syntheses and functions of polymers based on amino acids". Macromolecular Chemistry and Physics. 200: 2651–61. doi:10.1002/(SICI)1521-3935(19991201)200:12<2651::AID-MACP2651>3.0.CO;2-P.
- ↑ Gross, R. A.; Kalra, B. (2002). "Biodegradable Polymers for the Environment". Science. 297 (5582): 803–807. doi:10.1126/science.297.5582.803. PMID 12161646.
- ↑ Low, K. C. (1996). Commercial poly(aspartic acid) and Its Uses. Advances in Chemistry Series. Juz. la 248. Washington, D.C.: American Chemical Society.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ↑ Thombre, S.M.; Sarwade, B.D. (2005). "Synthesis and Biodegradability of Polyaspartic Acid: A Critical Review" (PDF). Journal of Macromolecular Science, Part A. 42 (9): 1299–1315. doi:10.1080/10601320500189604.
- ↑ Bourke, S. L.; Kohn, J. (2003). "Polymers derived from the amino acid l-tyrosine: polycarbonates, polyarylates and copolymers with poly(ethylene glycol)". Advanced Drug Delivery Reviews. 55 (4): 447–466. doi:10.1016/S0169-409X(03)00038-3. PMID 12706045.
- ↑ Elmore, Donald Trevor; Barrett, G. C. (1998). Amino acids and peptides. Cambridge, UK: Cambridge University Press. ku. 48–60. ISBN 0-521-46827-2.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Gutteridge A, Thornton JM (2005). "Understanding nature's catalytic toolkit". Trends in Biochemical Sciences. 30 (11): 622–9. doi:10.1016/j.tibs.2005.09.006. PMID 16214343.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ McMurry, John (1996). Organic chemistry. Pacific Grove, CA, USA: Brooks/Cole. uk. 1064. ISBN 0-534-23832-7.
- ↑ Strecker, Adolph (1850). "Ueber die künstliche Bildung der Milchsäure und einen neuen, dem Glycocoll homologen Körper". Justus Liebigs Annalen der Chemie. 75 (1): 27–45. doi:10.1002/jlac.18500750103.
- ↑ Strecker, Adolph (1854). "Ueber einen neuen aus Aldehyd - Ammoniak und Blausäure entstehenden Körper". Justus Liebigs Annalen der Chemie. 91 (3): 349–51. doi:10.1002/jlac.18540910309.
- ↑ Masumoto S, Usuda H, Suzuki M, Kanai M, Shibasaki M (2003). "Catalytic enantioselective Strecker reaction of ketoimines". Journal of the American Chemical Society. 125 (19): 5634–5. doi:10.1021/ja034980. PMID 12733893.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ↑ Davis, F. A. (1994). Tetrahedron Letters. 35: 9351.
{{cite journal}}: Missing or empty|title=(help) - ↑ Ishitani, Haruro; Komiyama, Susumu; Hasegawa, Yoshiki; Kobayashi, Shū (2000). "Catalytic Asymmetric Strecker Synthesis. Preparation of Enantiomerically Pure α-Amino Acid Derivatives from Aldimines and Tributyltin Cyanide or Achiral Aldehydes, Amines, and Hydrogen Cyanide Using a Chiral Zirconium Catalyst". Journal of the American Chemical Society. 122 (5): 762–6. doi:10.1021/ja9935207.
- ↑ Huang, Jinkun; Corey, E. J. (2004). "A New Chiral Catalyst for the Enantioselective Strecker Synthesis of α-Amino Acids". Orgic Letters. 62 (6): 5027–9. doi:10.1021/ol047698w. PMID 15606127.
- ↑ Duthaler, Rudolf O. (1994). "Recent developments in the stereoselective synthesis of α-aminoacids". Tetrahedron. 50 (6): 1539–1650. doi:10.1016/S0040-4020(01)80840-1.
- ↑ Ibba M, Söll D (2001). "The renaissance of aminoacyl-tRNA synthesis". EMBO Reports. 2 (5): 382–7. doi:10.1093/embo-reports/kve095. PMC 1083889. PMID 11375928.
{{cite journal}}: Unknown parameter|doi_brokendate=ignored (|doi-broken-date=suggested) (help); Unknown parameter|month=ignored (help) - ↑ Lengyel P, Söll D (1969). "Mechanism of protein biosynthesis". Bacteriological Reviews. 33 (2): 264–301. PMC 378322. PMID 4896351.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Wu G, Fang YZ, Yang S, Lupton JR, Turner ND (2004). "Glutathione metabolism and its implications for health". The Journal of Nutrition. 134 (3): 489–92. PMID 14988435.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ↑ Meister A (1988). "Glutathione metabolism and its selective modification". The Journal of Biological Chemistry. 263 (33): 17205–8. PMID 3053703. Ilihifadhiwa kwenye nyaraka kutoka chanzo mnamo 2020-06-10. Iliwekwa mnamo 2010-11-30.
{{cite journal}}: Unknown parameter|dead-url=ignored (|url-status=suggested) (help); Unknown parameter|month=ignored (help) - ↑ Carpino, Louis A. (1992). "1-Hydroxy-7-azabenzotriazole. An efficient peptide coupling additive". Journal of the American Chemical Society. 115 (10): 4397–8. doi:10.1021/ja00063a082.
- ↑ Marasco D, Perretta G, Sabatella M, Ruvo M (2008). "Past and future perspectives of synthetic peptide libraries". Current Protein & Peptide Science. 9 (5): 447–67. doi:10.2174/138920308785915209. PMID 18855697.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ↑ Jones, Russell Celyn; Buchanan, Bob B.; Gruissem, Wilhelm (2000). Biochemistry & molecular biology of plants. Rockville, Md: American Society of Plant Physiologists. ku. 371–2. ISBN 0-943088-39-9.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Stryer, Lubert; Berg, Jeremy Mark; Tymoczko, John L. (2002). Biochemistry. San Francisco: W.H. Freeman. ku. 639–49. ISBN 0-7167-4684-0.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Kivirikko KI, Pihlajaniemi T (1998). "Collagen hydroxylases and the protein disulfide isomerase subunit of prolyl 4-hydroxylases". Advances in Enzymology and Related Areas of Molecular Biology. 72: 325–98. PMID 9559057.
- ↑ Whitmore L, Wallace BA (2004). "Analysis of peptaibol sequence composition: implications for in vivo synthesis and channel formation". European Biophysics Journal. 33 (3): 233–7. doi:10.1007/s00249-003-0348-1. PMID 14534753.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Alexander L, Grierson D (2002). "Ethylene biosynthesis and action in tomato: a model for climacteric fruit ripening". Journal of Experimental Botany. 53 (377): 2039–55. doi:10.1093/jxb/erf072. PMID 12324528.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Urry, Dan W. (2004). "The change in Gibbs free energy for hydrophobic association: Derivation and evaluation by means of inverse temperature transitions". Chemical Physics Letters. 399 (1–3): 177–83. doi:10.1016/S0009-2614(04)01565-9.
- ↑ Magee T, Seabra MC (2005). "Fatty acylation and prenylation of proteins: what's hot in fat". Current Opinion in Cell Biology. 17 (2): 190–6. doi:10.1016/j.ceb.2005.02.003. PMID 15780596.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Pilobello KT, Mahal LK (2007). "Deciphering the glycocode: the complexity and analytical challenge of glycomics". Current Opinion in Chemical Biology. 11 (3): 300–5. doi:10.1016/j.cbpa.2007.05.002. PMID 17500024.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Smotrys JE, Linder ME (2004). "Palmitoylation of intracellular signaling proteins: regulation and function". Annual Review of Biochemistry. 73: 559–87. doi:10.1146/annurev.biochem.73.011303.073954. PMID 15189153.
- ↑ 88.0 88.1 88.2 88.3 Hausman, Robert E.; Cooper, Geoffrey M. (2004). The cell: a molecular approach. Washington, D.C: ASM Press. uk. 51. ISBN 0-87893-214-3.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Kyte J, Doolittle RF (1982). "A simple method for displaying the hydropathic character of a protein". Journal of Molecular Biology. 157 (1): 105–32. doi:10.1016/0022-2836(82)90515-0. PMID 7108955.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ 90.0 90.1 Freifelder, D. (1983). Physical Biochemistry (tol. la 2nd). W. H. Freeman and Company. ISBN 0-7167-1315-2.[page needed]
- ↑ Suchanek M, Radzikowska A, Thiele C (2005). "Photo-leucine and photo-methionine allow identification of protein-protein interactions in living cells". Nature Methods. 2 (4): 261–7. doi:10.1038/nmeth752. PMID 15782218.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link)
Marejeo
[hariri | hariri chanzo]- Doolittle, RF (1989) Vitu visivyohitajika katika Utaratibu wa protini. Katika utabiri wa Muundo wa protini na Kanuni za kuwiana kwa protini (Fasman, G.D ed) Plenum Press, New York, uk 599-623.
- David L. Nelson na Michael M. Cox, Kanuni za Biokemia chake Lehninger , toleo la 3, 2000, Worth Publishers, ISBN 1-57259-153-6
- Meierhenrich, UJ: Asidi amino na kutokuwa pacha kwa maisha, Springer-Verlag, Berlin, New York, 2008. ISBN 978-3-540-76885-2
- Morelli, Robert J. "Mafunzo ya kufyonzwa kwa asidi amino kutoka utumbo mdogo. " San Francisco: Morelli, 1952.
Viungo vya nje
[hariri | hariri chanzo]- Muhtasari wa asidi amino sifa za kimaumbile-kemia , miundo ya 3D, nk
- Orodha ya asidi amino za kawaida Archived 10 Novemba 2010 at the Wayback Machine. Orodha ya undani ya PDF ya asidi amino za kawaida (ikiwa ni pamoja na picha za 3D)
- Mfano kwa majina na picha ya asidi amino na Peptidi IUPAC-IUB Tume ya Pamoja ya majina ya Bayokeia (JCBN)
- Maelezo ya Masi: Ukusanyaji wa Asidi Amino - Ina taarifa za kina na picha za darubini za asidi amino.
- Sifa za Asidi amino Archived 27 Septemba 2007 at the Wayback Machine. - Sifa za asidi amino (chombo kinachowalenga wanasayansi wa jeni za molekuli wanaojaribu kuelewa maana ya mabadiliko)
- Usanisi wa asidi amino na minyambuliko yao
- Jifunze juu ya asidi amino proteinojeniki 20 kwa mtandao Archived 29 Oktoba 2010 at the Wayback Machine.
- Asili ya mfumo wa herufi moja ya asidi ya amino
- PH ya mchanganyiko wa Asidi amino, kuchanganya kwa kemikali na hesabu ya ncha ya isoelektriki
- Pages using the JsonConfig extension
- CS1 maint: multiple names: authors list
- CS1 errors: access-date without URL
- CS1 errors: unsupported parameter
- CS1 errors: explicit use of et al.
- CS1 maint: unflagged free DOI
- CS1 errors: redundant parameter
- CS1 errors: missing title
- All pages needing cleanup
- Wikipedia articles needing page number citations
- Kemia
